|
结构生物学家提供了ALS-相关遗传缺陷如何干扰TDP-43蛋白质适当功能和行为的新解释
& S: j% B* D, G. D) Y- n
2016年8月22日/生物谷BIOON/--在遭受肌萎缩侧索硬化(ALS)损害的神经元和胶质细胞中,几乎总是存在TDP-43蛋白质聚合物。与此同时,大约50个ALS-相关突变已知会影响TDP-43的特定区域,但科学家们一直未能理解二者之间如何发生联系。在最新发表于《结构(Structure)》期刊的研究中,布朗大学(Brown University)研究人员揭示了ALS突变如何在原子层面上破坏TDP-43蛋白质,导致其无法执行适当功能并形成聚合物。
& F. h/ ]+ V9 g1 P
5 _6 d+ R; l9 a* Y
“我们知道TDP-43的一部分会形成聚合物,而且在那个结构域存在50个突变。但是我们不知道那个结构域的功能,它是如何出错以及为什么会聚集” 该研究通讯作者、布朗大学分子药理学、生理学和生物技术系助理教授Nicolas Fawzi说道。
* j$ f. t5 @1 ~5 @7 r/ `
+ [1 }# l- v* |( g0 @
一般而言,TDP-43在细胞中就像是 RNA的伴侣。结合到RNA,指导其加工,将其运输到需要的位置并进行调节,以便使其他蛋白质得以正确表达。使用核磁共振、计算机模拟和显微镜法,Fawzi、布朗研究生Alexander Conicella和利哈伊大学(Lehigh University)的同事们之前表明,在正常情况下,TDP-43分子会浓缩为小液滴,该过程被称为“液-液相分离(liquid-liquid phase separation)”。在这些液滴中,它们可以加工和运输RNA。
" S3 L. {8 ]0 g% }$ U- w U% g
. C' {3 j/ I3 ]7 U* R8 q6 j
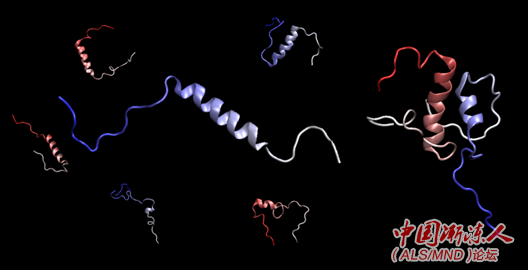
该团队的研究重点是被称为“C-端结构域(C-terminal domain)”的TDP-43特定区域,该区域似乎对分子浓缩和相分离是至关重要的。
3 ?* N+ H( N5 W9 E; N5 B
“我们一直在在寻找TDP-43蛋白质该部分的功能性作用” Fawzi说,“它不会是无所事事,然后在疾病中聚合。”
4 G7 C; `/ a0 t5 c9 b v
观测结果显示,TDP-43分子的相互作用和所产生的浓缩取决于该蛋白C-端结构域的一个小螺旋状部分,术语称为helix(螺旋)。相同的DNA序列规定螺旋形状在许多脊椎动物的进化中被完全保留,暗示螺旋形状拥有重要的生物功能。 3 f) B1 I7 \4 a9 D2 n; S
Fawzi及其团队观察到的是,随着一个TDP-43分子遇到另一个TDP-43分子,螺旋会稳定并延长,促进它们之间的结合。
: `5 P3 c. g$ u7 ]1 ?
8 a) P) }. v$ z, P
新研究解释了TDP-43蛋白质如何正常浓缩为液滴,解释了ALS-相关突变如何扰乱这一过程并使TDP-43蛋白质形成损害细胞的聚合物。
: s- @: v0 ]. c, Y+ L0 Y 最后,研究团队在论文中表示,各种ALS突变会扰乱螺旋的形成或影响其延长和稳定的能力,从而破坏上述过程。 % y) ?6 ~! n0 D9 w; V" {
“这一(螺旋)区域中的突变会打击相互作用结合” Fawzi说。
9 m! @5 v5 y/ H- x' U
其结果是,浓缩和相分离无法实现。反而,蛋白质会以潜在更有害的方式结合——在病变神经元内可见的聚合物之中。
* @* C; b2 P+ a* C; h' j# Q! G8 t
通过挖掘出突变和蛋白质失去适当相分离行为以及如何使分子聚合之间的机械连接,研究团队表明了突变如何可能导致疾病的方式,Fawzi说道。 $ T5 C, {& d$ O
“这可能是ALS突变通过扰乱TDP-43正常功能而导致ALS的一种机制” 他说道。 0 X E! x% ~+ c# q& h# K5 O
( {& \1 ^: [0 V. |0 B& D' ]
论文进一步强调了一个ALS全局性问题的紧迫性。只有约10%的ALS病例可追溯到遗传原因。还不清楚的是,在大量散发型病例中是什么问题扰乱了TDP-43(的正常功能)。
* g$ X9 l' l; U" I$ N4 F
但是现在科学家们拥有了一套新的数据,和对TDP-43如何工作以及什么使其失效的解释。 5 S- A# h; Q" A# X+ e' g* A4 C3 M
这是同样重要的,Fawzi指出,因为TDP-43还涉及其他退行性神经疾病。
4 U, M4 a5 G/ @; R4 k
“考虑到最近的证据表明TDP-43也在阿尔茨海默病中积聚,理解TDP-43的作用变得更为迫切” 他说道。(生物谷bioon.com)
1 r4 e! O( L3 z) h
- e R3 B) r/ U$ I8 N) @
3 a; x6 z0 C( o" Q/ k; W | 




 发表于 2016-8-19 18:59:48
发表于 2016-8-19 18:59:48






 发表于 2016-8-20 11:31:40
发表于 2016-8-20 11:31:40

 楼主
楼主
 发表于 2016-8-23 19:45:18
发表于 2016-8-23 19:45:18