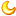2018年11月20日——在一项本月早些时候发表于《通讯生物学》(Communications Biology)杂志的研究中,多伦多大学研究人员表明,在一些神经退行性疾病中,细胞衰老的两个特征——蛋白质聚合和一种类型的DNA不稳定——是相互关联的。它们之前被认为没有联系。 2 m/ _% o! x. ~4 C
研究人员使用了肌萎缩性侧索硬化(ALS)和脊髓小脑性共济失调的细胞模型,发现特定蛋白质的胶结(gumming up)会逐渐破坏核糖体DNA重复序列(制造所有蛋白质和细胞所必需的重复基因序列)的稳定性。
& x: S8 r* G) L! x0 w. }
7 _7 m! m! |* f
“我们发现,蛋白质聚合物会损害高度重复的核糖体DNA序列的稳定性,因而缩短细胞的寿命,” 多伦多大学医学院实验医学与病理生物学系副教授Karim Mekhail说道。
; m7 E/ V5 Y' ^: i; \+ M! [
“两种细胞衰老的主要机制是相互联系的,这指出了神经变性退化中可能一石二鸟的策略。” ( y( j" R/ X y* V- c/ N
重复DNA序列占有些生物基因组的一半以上,对细胞功能至关重要。但它们易受重组(reorganization)的影响,重组会导致染色体重排、细胞早衰和疾病。
2 C5 ^5 u! R9 Q) S! x
Mekhail和他的团队,包括博士生Lauren Ostrowski和Amanda Hall,首先发现 “制造麻烦” 的蛋白质——来自被称为转座子的重复DNA序列——聚合在携带ALS和共济失调患者突变的人化酵母细胞中。他们随后绘制出聚合物如何破坏核糖体DNA重复的稳定性并导致酵母菌细胞早衰(的图谱)。最后在人类细胞中确认了这些发现。
- V' }4 y/ s& `( Z$ W3 c7 [
图:博士生AmandaHall和Lauren Ostrowski以及副教授Karim Mekhail : v b2 n) n9 C6 t
这项研究历时4年多。“整个过程充满了惊喜,” Mekhail说,“回想起来,这些发现似乎是显而易见的,但如果你一开始告诉我们蛋白质聚合和DNA不稳定之间存在相互作用,我们会认为这是荒谬的。”
; s. I2 j7 Y3 `9 b
为了识别新的和迫切需要的治疗方法,研究人员正在针对各种神经退行性疾病测试那些分解转座子蛋白聚合物的药物能否恢复基因组稳定性和细胞寿命。
+ q* B# y( Q3 ^; [' P8 ~( p/ W5 t
5 Z# M& p( ^- U: m4 {3 Y; b
# L9 @& H7 ^/ _& g8 X- e# ^6 I/ @
| 




 发表于 2018-11-23 04:59:31
发表于 2018-11-23 04:59:31



 发表于 2018-11-23 08:41:15
发表于 2018-11-23 08:41:15