田纳西州孟菲斯市,2019年4月10日——在一项最新发表于《分子细胞》(Molecular Cell)杂志的研究中,圣裘德儿童研究医院的科学家们揭开了围绕肌萎缩侧索硬化(ALS)最常见遗传病因的谜团,为这种致命疾病的诊断和治疗提供了可能的新方法。
4 o/ {# E8 x4 G5 g9 }1 h
4 X& S5 V% H* G2 S& q2 {6 n) @+ O
大约35%的ALS病例与C9orf72基因突变有关,使其成为ALS和另一种神经疾病——额颞叶痴呆(FTD)最常见的遗传病因。该突变会导致短重复DNA序列的数量大幅增加,并形成不同长度的异常重复蛋白质。这些蛋白质被称为二肽重复多肽(DPRs),含有的氨基酸精氨酸对神经元特别具有毒性。
2 `+ S' V2 a) _. N
在此之前,所涉及分子机制的关键细节还不确定。
: j2 m7 L. S( e' W' m! A6 v) Y
' A1 K. O$ X% X m0 k. y
图:通讯作者Richard Kriwacki博士,第一作者Michael White博士和Diana Mitrea博士
8 Q' R: V; `# |! k! \
“我们已经识别出核仁磷酸蛋白(nucleophosmin)是DPR毒性的一个位点,” 该研究通讯作者、圣裘德结构生物学系Richard Kriwacki博士说,“我们还表明,DPR的毒性与长度密切相关。在未来,DPR长度可能对ALS患者有预后价值。”
- u A% ?. J. O& K$ b# b0 [
ALS、DPRs和疾病
. B1 T5 y# h6 X& A. W
ALS是一种进展迅速的神经疾病,会杀死负责控制随意肌的神经细胞。FTD是由大脑中神经细胞丢失引起的。目前这两种疾病都无法治愈。
3 S, h. U2 v$ v1 `
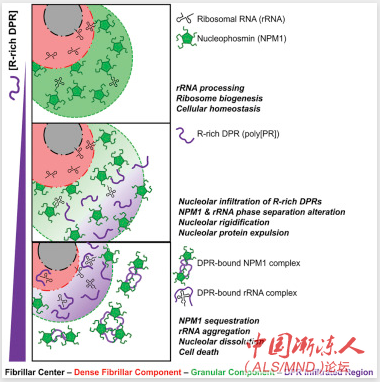
通常,C9orf72基因的一个片段重复20到30次或更少。然而,ALS和FTD患者则有数百甚至数千次的重复,随后导致DPRs形成。Kriwacki等人之前的研究报告,毒性(含精氨酸的)DPRs会破坏细胞中最大无膜细胞器核仁的装配和功能。这项新研究强调了DPRs如何破坏核仁装配,还表明更长的DPRs对细胞的毒性明显更大。
6 l" f6 {1 y) {" ^
核仁位于细胞核内,是细胞的蛋白质工厂(核糖体)装配的地方。与细胞核不同的是,核仁缺少一层膜。核仁这样的无膜细胞器依赖于一种被称为液-液相分离的过程来形成并给予细胞对条件改变作出反应的灵活性。液-液相分离过程可以解释为什么油会在水中形成液滴。
' Q/ ^, Z1 T+ b# u* d* V( u
不速之客
) O+ @2 @: j6 m& z
Kriwacki和他的同事们发现,毒性DPRs通过与核仁磷酸蛋白的关键区域紧密结合、取代有助于维持核仁和核糖体装配的其他结合伙伴而破坏细胞功能。毒性DPRs的浓度越大,无膜核仁改变和溶解的速度越快。
7 w* M; X/ E3 d" m5 s6 D9 L
# E0 d1 q( R- h' \, y u
DPRs在大型复合物中结合并隔离核仁磷酸蛋白,导致核仁部分溶解。研究人员发现,毒性DPRs还会通过结合和分离核糖体RNAs这一核糖体的关键组分而破坏细胞功能。
/ V5 Y& O- ]0 F; J
NMR
, a# R$ c/ E0 h* s
根据计划安排,圣裘德儿童研究医院今年晚些时候将安装一套1.1 GHz核磁共振(NMR)系统,Kriwacki说该系统巩固了上述发现。该系统目前在瑞士苏黎世的制造商那里,拥有世界上最强大的高分辨率NMR磁铁,以加强对生物样本的研究。研究人员在这项研究中使用它来更详细地揭示出毒性DPRs如何结合到核仁磷酸蛋白固有无序的区域。
. H" \: Z* I. C
临床可能性
$ O8 p3 i5 j/ T/ m
“这项研究也为思考靶向患者细胞中毒性DPRs及其作用位点的可能疗法提供了新的方向,” 该研究第一作者、Kriwacki实验室博士后研究员Michael White博士说道。
- c ?9 Q: `1 u3 _- H2 u
“成功需要完全创新的方法,” Kriwacki说,“但至少现在我们知道了需要针对的目标。”
. C% d M' x& X) r ~
# G4 P/ M* o% ~: m U9 I& m7 C





 发表于 2019-4-15 22:31:28
发表于 2019-4-15 22:31:28


 发表于 2019-4-15 22:33:56
发表于 2019-4-15 22:33:56

 发表于 2019-4-16 07:42:33
发表于 2019-4-16 07:42:33

