3 V6 k6 g+ o5 O8 |4 Y0 s
在最新发表于《分子与细胞生物学》(Molecular and Cellular Biology,MCB)杂志的研究中,亚利桑那大学研究人员的意外发现可能导向对肌萎缩侧索硬化(ALS)的治疗干预。
5 {0 j: g+ F/ `, l' x" I: L
6 p3 o9 ], O& S- z" t# e4 B6 l4 Y. @
在ALS和其他神经退行性疾病患者的神经元细胞内,经常会发现两种蛋白质——TDP-43和FUS——存在于被称为聚合物的分子垃圾团簇中,积累到致命的水平。
, q/ h" O1 ]3 H( {1 w
“目前还不清楚TDP-43聚合物是本身有毒抑或仅仅是细胞状况恶化的表现。” 分子与细胞生物学助理教授、BIO5研究所成员Ross Buchan说,“这些聚合物可能是有毒的,因为它们会困住其他有用的分子,导致其无法发挥作用。”
2 t' Q3 e: L9 u7 ~5 {
Buchan和他的团队着手研究健康细胞如何清除细胞内的有害聚合物。
7 Y$ ]4 ~7 b# _+ D9 r
他们发现这些聚合物通过内吞作用(endocytosis)被清除,这是令人惊讶的,原因有二:1. 教科书上对内吞作用的定义是细胞外的蛋白质、营养物质和化学信号被带入细胞内由溶酶体降解和回收的过程,但在该研究的情况中,内吞作用却作用于细胞内的聚合物。2. 已经存在被称为自噬的机制用来回收细胞内的垃圾,然而内吞作用却在从事自噬本该做的工作。
0 ? U( b/ J2 E/ w+ D8 u% |
- ^( |% {; D* N ^6 s
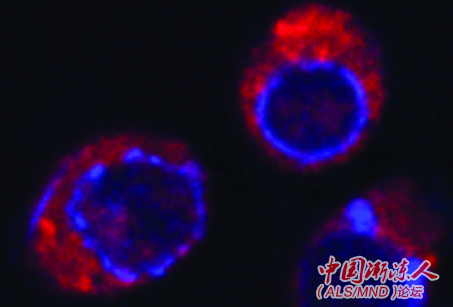
图:酵母中表达的TDP-43蛋白(红色)。其中一些正被送到被称为液泡(蓝色圆圈,相当于人类溶酶体)的细胞器内。Buchan还将溶酶体描述为细胞内吞和自噬发送其底物的垃圾压缩机/回收站。
5 B4 Q- `1 c! I( m6 a5 u8 m4 n' i
Buchan说:“内吞作用通常会随着我们的年龄增长而减缓(自噬可能也是如此,但还不确定),而且该通路中发生突变的基因与一些神经退行性疾病相关联。所以人们认为,当我们上年纪或者罹患这些疾病时,由于该通路功能下降,聚合物就会发生。”
$ c& [/ \4 K2 H5 ~9 y
此外,聚合物的积累会进一步减缓内吞作用通路,在细胞内形成负反馈回路。
# q4 g( U/ M: i" s# q9 d/ y
“如果我们通过遗传学或化学方法阻碍这一通路,TDP-43蛋白就会积聚,变得非常具有毒性。就ALS的治疗而言,最酷的是我们可以通过过度表达部分内吞作用通路来让它更好地工作,就好像踩下油门让它跑得更快一样。这样一来,TDP-43聚合物就可以被有效地清除,而且不再有毒。”
8 u( E6 J2 D" C) [1 D. B
该研究的许多实验都是在酵母细胞中进行的,但基于最初的发现,整体结果可以转化到人类细胞中。Buchan称酵母为“一种强大的遗传工具”,可用于了解细胞过程,包括人类疾病的细胞过程。
8 R8 E$ i! Z, w" y# @# h
2 _# Z% e+ l- ]' @4 f
图:研究生Aaron Byrd、分子与细胞生物学助理教授Ross Buchan和本科四年级学生Amanda Warner在实验室。
* `/ C1 S. h. f- F6 N( C& j
虽然Buchan实验室的结果是出乎意料的——“毕竟教科书告诉我们内吞作用发生在细胞外而非细胞内”——但其他实验室的数据提示内吞作用也可以清除内部化的蛋白质。
! O3 M7 h- \" m
下一步是确定TPD-43和FUS是如何进入内吞作用通路的,然后开发使这些细胞中内吞作用更好发挥功能的方法。
! X$ {: a; B; K+ n" X
“目前遗传学方法可以做到这一点,不过还没有化学方法。” Buchan说,“我们认为如果有药物可以抑制细胞内吞作用的负调节因子,那么该通路就会变得更快。我们已经有了一些想法。”
3 Z9 A8 C! Y8 N
* V* H7 x6 ?2 {) O/ o( e
- N3 I8 A1 Q8 ~: i6 @* T




 发表于 2020-2-25 23:15:41
发表于 2020-2-25 23:15:41




 发表于 2020-2-25 23:32:41
发表于 2020-2-25 23:32:41
