0 B, c+ @* N2 c1 g" g 运动神经元通过神经肌肉接头(NMJ)与骨骼肌直接接触,发送收缩或放松信号,控制身体的随意运动。在某些神经退行性疾病比如肌萎缩侧索硬化症(ALS)中,NMJ被破坏,导致患者进行性肌肉无力并最终瘫痪麻痹。ALS的治疗目前主要集中于缓解症状,还无法阻止或逆转其进展。 + f# E k/ ~. E
4 o* Z2 b" v( H& n6 M* W, X
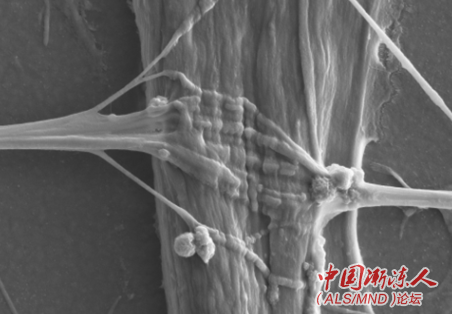
为了找到更有效的治疗方法,研究人员需要精确而易于获得的实验室模型来了解ALS的病因,并开发和测试新的疗法。在最近发表于《干细胞报告》(Stem Cell Reports)的研究中,比利时研究人员Ludo Van DenBosch及其同事们朝着这个方向迈进了一步,通过微流控设备(microfluidic device)在体外产生了NMJ。在这个精细模型中,研究人员将运动神经元和骨骼肌细胞分别生长在装置两侧不同的小室中,小室则通过微小通道相连接。其中运动神经元利用ALS患者皮肤衍生的诱导多能干细胞分化而来,而骨骼肌细胞来自健康捐赠者。
. i& Y4 Z/ C& J( P
随着时间推移,神经元开始发出被称为轴突的连接,穿过通道形成能够将信号从神经元传递到肌肉细胞的NMJ,类似于人体内的NMJ。不过,与健康运动神经元相比,ALS患者的运动神经元穿过通道发送的轴突更少,与肌肉细胞形成的NMJ更少。此外,ALS运动神经元对受损轴突的再生效率也较低。 % C; w5 F- v2 d) r5 r* g j
$ W' y' T9 s0 c
研究人员发现,在培养物中加入化学物质Tubastatin A,ALS运动神经元可以生长出更多的轴突,达到与健康运动神经元相似的水平。进一步的研究将探索Tubastatin A如何通过抑制细胞中特定种类的蛋白质而促进ALS运动神经元的轴突生长,以及是否可以在动物模型并最终在ALS患者中实现类似的效果。这种新的NMJ形成的微型化模型,有望广泛用于研究运动神经元病理和发现ALS潜在疗法。
/ Z$ G, r! V# _
% ?8 S6 V1 r. ~8 b h ^
% C7 c& C: S6 h; }2 d | 




 发表于 2021-6-27 20:38:56
发表于 2021-6-27 20:38:56


 发表于 2021-6-28 13:22:24
发表于 2021-6-28 13:22:24

