. n( K4 d* u* A7 b
一项新研究在单个原子水平上详细说明导致一种特定蛋白质形成与ALS和其他疾病相关的细胞损伤团块的细微改变。
$ v' M, @9 j- v% k& X% x
罗德岛州普罗维登斯,2018年1月18日——研究人员首次描述一个家族蛋白质中原子水平的改变。该族蛋白质与肌萎缩侧索硬化(ALS)和额颞叶痴呆(FTD)等退行性疾病相关。他们的发现发表于《分子细胞》(Molecular Cell)期刊。
8 F! R3 N( a/ S1 X1 p2 o
6 L9 \# e4 `& A& }
这项研究的长期目标是使用药物或其他疗法来靶向作用于该细胞通路,从而预防这些疾病,该研究高级作者、布朗大学分子药理学、生理学和生物技术系助理教授Nicolas Fawzi说,“目前ALS和FTD还无法治愈或有效治疗。我们正在寻求新的假设和角度来对抗这些疾病。”
% n7 s D% N* s0 A5 }( x5 w
许多和这些疾病相关的蛋白质含有“低复杂度”域或片段。与细胞中结构有序和静态因而最容易理解的蛋白质相比,低复杂度域是蠕动和无序的。这些蛋白质的形状不是刚性的,而是有弹性的,漂浮在细胞内部直到发挥作用。
4 d! u, [8 U( R: I1 X, ]' b
在非疾病状况下,低复杂度域有助于蛋白质发挥健康的功能,包括组装成液体样的液滴,重要的细胞过程(比如RNA加工)在这些液滴中发生。
; }# L# x+ e, z ^0 Y* c/ A( w& k
当低复杂度域出错时,就像疾病中那样,它们会转化为包含物、难以处理而积聚的缠结或团块。在某些癌症中,低复杂度域不恰当地附着在其他蛋白质上,这些蛋白质随后可能会在细胞位置上不正确地形成液滴,导致基因的错误调节,Fawzi说道。
: S5 F+ Y- k( `) q e; V( G6 J/ f) V
“我们正在试图理解它们改变行为并聚合的原因,以及我们如何能中断这些过程,” 他说道。
. t# e2 i3 }/ @! s# M5 w
$ R* P( ~) s1 R' p" @% l
在这项研究中,研究人员们描述了与几种细胞功能(包括疾病形式)相关的蛋白质的微观物理相互作用和化学变化,以及健康细胞如何试图抑制它。
* \. N- S/ {# W" d
“我们表明了微小的化学改变——只涉及几个原子——如何导致组装中的巨大改变和疾病相关聚合,” Fawzi说,“这些相互作用比之前想象的更有活力,也更不具体。一个分子不只采用一种形状和结合为一种形状,而是有弹性的并以灵活的方式相互作用。”
' r0 Y- q+ t* [6 _
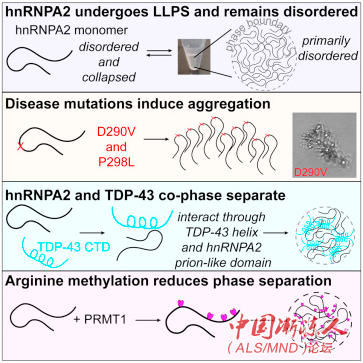
细胞在被称为细胞器的不同细胞结构中划分它们的功能,传统上认为细胞器被膜包裹着。研究人员们研究了一种在疾病中发生突变的被称为hnRNPA2的蛋白质。该蛋白质在无膜细胞器中收集,在那里可能利用其低复杂度域粘在一起,就像在潮湿的夏日里,水汽在冰冷的苏打瓶外凝结成液滴一样。在这项研究发表之前,关于hnRNPA2低复杂度域如何发挥作用的几个机械细节以及它如何在疾病中变成聚合物是未知的。
7 ]8 i+ l% ^3 M* l- O9 D% I! V2 T' p
利用核磁共振(NMR)光谱、计算机模拟和显微技术,研究人员显示了疾病突变和精氨酸甲基化(一种与拥有低复杂度域的一大家族蛋白质共同作用的功能性修饰)如何改变液体液滴的形成和转化为疾病中的固态状态。
p7 d) P2 I/ U# f3 w$ |# \, r# L4 \
. R4 g4 n! q' W( H; `
图:蛋白质团块。hnRNPA2蛋白质在试管中形成液体液滴,就像光学显微镜所观察到的那样。这些结构让研究人员在原子细节上测试疾病突变和功能修饰如何改变蛋白质的行为。
; }2 n' ^6 i7 Y: X! g! d) J* b
Fawzi说,这些发现解释了过去20年来关于hnRNP家族蛋白质在神经元功能和神经变性中作用的若干研究。
5 ^6 q, Q9 Y( r
此前,Fawzi和同事们描述了一种相关蛋白质的结构和生物物理学,以及ALS相关遗传缺陷如何干扰其适当功能和蛋白质家族另一成员的和行为,导致它发生聚合。一项单独研究揭示了防止这些团块形成的可能方法。
3 g3 e, m* {" W( o5 H+ _% w3 K
“因为这些低复杂度域过于灵活,无法被标准药物直接靶向作用,因此,搞清楚细胞如何使用和驯服这些域,是一种阻止它们在疾病中不必要组装的潜在途径。”
- ~9 q h9 R8 U& g! ?- @* `
0 M9 L3 @6 h+ e" F( i
0 `4 S4 x' c: j




 发表于 2018-1-20 03:19:14
发表于 2018-1-20 03:19:14



 发表于 2018-1-20 06:00:23
发表于 2018-1-20 06:00:23

 发表于 2018-1-20 07:43:04
发表于 2018-1-20 07:43:04

