|
. \ n; s% @+ c' G$ F. z" Y9 X# m
3 v* q+ F v" y, d/ @. w0 d
* m+ H! W) i5 }7 |
# r9 N Q7 e9 i6 e1 Y5 Z/ S" V Q
费城,2018年2月19日——卢伽雷氏症,又称肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS),通常以运动神经元选择性死亡为标志。但是有神经学家怀疑存在其他种类脑细胞参与该病的进程——也许具有保护性,可能为这种不治之症的治疗方法指引新的方向。为了彻底解决这一问题,宾夕法尼亚大学佩雷尔曼医学院(Perelman Schoolof Medicine)的研究人员们利用了转基因小鼠,发现这些小鼠中突变人类TDP-43蛋白质导致的损伤可能被一种大脑免疫细胞逆转。TDP-43是一种在ALS患者中错误折叠并积累于大脑运动区域的蛋白质。 . M# E7 @# y: y% E6 h4 }
文章第一作者、博士后研究员Krista J. Spiller博士和通讯作者、神经退行性疾病研究中心主管、病理学与实验室医学教授Virginia M-Y Lee博士本周在《自然•神经科学》(Nature Neuroscience)上发表了他们的研究成果。 5 p1 }+ H4 l, E; t2 E
0 ~5 n6 I1 H( |& D$ p0 H$ D3 n/ @ k
他们发现,小胶质细胞——大脑和脊髓中首要和主要的免疫反应细胞——对于处理TDP-43相关神经死亡至关重要。这项研究首次论证了健康小胶质细胞在活体动物中如何应答病理性TDP-43蛋白质。
6 X% ? J4 I. r. t- X$ R
Lee认为:“该领域的流行观点一直认为免疫系统炎症会促进ALS中的神经元死亡,但这项研究显示出相反的结果——小胶质细胞实际上对于神经元的存活至关重要。” % Z3 ~: l7 i: A2 j) P/ {# p' V" Z
! e, ?5 }5 C3 N5 D( T1 _
% B5 Y" y. g" q) d6 [
在有ALS症状的小鼠中,小胶质细胞的数量仍然稳定。但是,研究人员们利用化学手段抑制病理性人类TDP-43蛋白质在小鼠体内的表达后,小胶质细胞急剧增殖并改变了形状以及它们表达的基因。
' ^: M4 M# i. k1 e$ S
研究人员们困惑于为何小胶质细胞没有自发地对突变TDP-43蛋白产生反应,以及抑制该蛋白表达如何刺激小胶质细胞反应。Spiller说:“这仍旧是个迷,但却是我们很想在未来研究中弄明白的问题。”
) j+ y7 ~5 U/ v: d
8 p$ [* f/ O( d6 r7 C* |0 X# N
) P4 ?2 \4 n. O! z. W
正常分枝的小胶质细胞会缩回它们的延伸,并扩大其主细胞体。(这种形状的迅速改变对于中枢神经系统中的小胶质细胞来说是十分独特的,虽然身体外周部分中与小胶质细胞免疫系统对应的巨噬细胞也会有相似的动态形状改变。)
0 n" x2 F! z, }1 c
大量再造的小胶质细胞一周后增殖了70%并且从运动神经元选择性清除累积的人类TDP-43蛋白质。小胶质细胞环绕充满TDP-43的神经元并开启基因,以制造能够帮助它们连接到病态细胞的蛋白质,同时诱导可以包裹突变蛋白进行处理的吞噬作用。清理完成后,小鼠停止表现出运动功能障碍症状(比如腿部僵硬和震颤),而且重新获得行走能力,体重增加。
% L9 c6 s6 }5 \% H# o5 j. h' o, Q/ L
Z: I% G/ t. N3 w
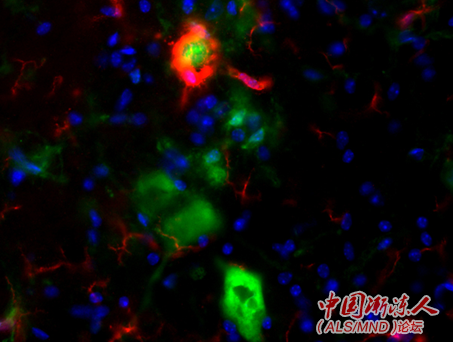
图:在转基因小鼠中抑制所转基因后,小胶质细胞(红色)环绕着脊髓中的运动神经元,并且积极地清除人类TDP-43蛋白质(绿色)。范围=100微米 7 M1 @2 b5 G' h; k1 b
相反,TDP-43蛋白质在没有小胶质细胞的小鼠中没有被完全清除。当小胶质细胞的增殖受阻时,小鼠没有重新获得完全的肌肉功能,揭示出小胶质细胞在清除错误折叠蛋白质团块过程中的重要性。 5 u# T# L0 n4 m9 \* i- Z" h6 L, v
“反应性小胶质细胞保护神经元的方式为我们治疗ALS提供了新的思路,” Spiller说,“例如,我们想要知道能否在早期ALS患者身上激励小胶质细胞扩张以保护他们的运动神经元。” , \4 [; z0 H* _: o* l% j+ T
6 N% F! W0 C) a, y0 M
原文链接:https://www.pennmedicine.org/news/news-releases/2018/february/brain-immune-system-is-key-to-recovery-from-motor-neuron-degeneration
) a8 ~2 E2 ]2 e' f0 d | 




 发表于 2018-3-8 23:58:08
发表于 2018-3-8 23:58:08





 发表于 2018-3-9 09:44:46
发表于 2018-3-9 09:44:46