田纳西州孟菲斯市,2019年4月10日——在一项最新发表于《分子细胞》(Molecular Cell)杂志的研究中,圣裘德儿童研究医院的科学家们揭开了围绕肌萎缩侧索硬化(ALS)最常见遗传病因的谜团,为这种致命疾病的诊断和治疗提供了可能的新方法。
" S" W3 Q+ |" F, Q5 l' M# Y3 G7 k3 r
# E# u) W, Q2 E. [; ~
大约35%的ALS病例与C9orf72基因突变有关,使其成为ALS和另一种神经疾病——额颞叶痴呆(FTD)最常见的遗传病因。该突变会导致短重复DNA序列的数量大幅增加,并形成不同长度的异常重复蛋白质。这些蛋白质被称为二肽重复多肽(DPRs),含有的氨基酸精氨酸对神经元特别具有毒性。
4 \) s( q' m1 f( K3 F1 o
在此之前,所涉及分子机制的关键细节还不确定。
4 J* P# ?5 y8 i# t- \7 \
; `/ {0 o- w' C) e
图:通讯作者Richard Kriwacki博士,第一作者Michael White博士和Diana Mitrea博士
) T7 y1 E2 m: j" |2 I. G+ ~1 D! G
“我们已经识别出核仁磷酸蛋白(nucleophosmin)是DPR毒性的一个位点,” 该研究通讯作者、圣裘德结构生物学系Richard Kriwacki博士说,“我们还表明,DPR的毒性与长度密切相关。在未来,DPR长度可能对ALS患者有预后价值。”
8 `$ v! y" f4 R% @# K
ALS、DPRs和疾病
* n: W% X! V, j& h3 R2 Z" o
ALS是一种进展迅速的神经疾病,会杀死负责控制随意肌的神经细胞。FTD是由大脑中神经细胞丢失引起的。目前这两种疾病都无法治愈。
0 P4 T8 q% K1 a" ~: y3 p) X+ j% T
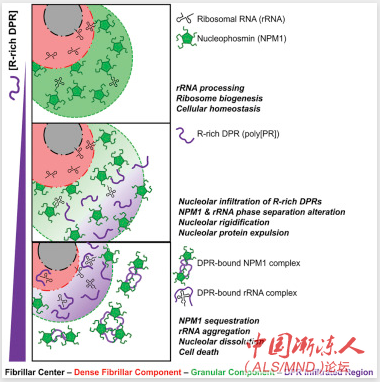
通常,C9orf72基因的一个片段重复20到30次或更少。然而,ALS和FTD患者则有数百甚至数千次的重复,随后导致DPRs形成。Kriwacki等人之前的研究报告,毒性(含精氨酸的)DPRs会破坏细胞中最大无膜细胞器核仁的装配和功能。这项新研究强调了DPRs如何破坏核仁装配,还表明更长的DPRs对细胞的毒性明显更大。
4 F' f7 w. s+ e/ B+ J% s; V
核仁位于细胞核内,是细胞的蛋白质工厂(核糖体)装配的地方。与细胞核不同的是,核仁缺少一层膜。核仁这样的无膜细胞器依赖于一种被称为液-液相分离的过程来形成并给予细胞对条件改变作出反应的灵活性。液-液相分离过程可以解释为什么油会在水中形成液滴。
9 X* z: U4 H# b& n- k
不速之客
% V1 n# ~0 m( }+ S7 a9 T$ e$ O* U
Kriwacki和他的同事们发现,毒性DPRs通过与核仁磷酸蛋白的关键区域紧密结合、取代有助于维持核仁和核糖体装配的其他结合伙伴而破坏细胞功能。毒性DPRs的浓度越大,无膜核仁改变和溶解的速度越快。
) u* f- y) S9 T1 I( q, q
( h! Y2 S& r2 Q! q$ o
DPRs在大型复合物中结合并隔离核仁磷酸蛋白,导致核仁部分溶解。研究人员发现,毒性DPRs还会通过结合和分离核糖体RNAs这一核糖体的关键组分而破坏细胞功能。
. x9 ?) ~# e0 b( O" _2 O
NMR
' K" _) i6 ]4 J! j6 C
根据计划安排,圣裘德儿童研究医院今年晚些时候将安装一套1.1 GHz核磁共振(NMR)系统,Kriwacki说该系统巩固了上述发现。该系统目前在瑞士苏黎世的制造商那里,拥有世界上最强大的高分辨率NMR磁铁,以加强对生物样本的研究。研究人员在这项研究中使用它来更详细地揭示出毒性DPRs如何结合到核仁磷酸蛋白固有无序的区域。
$ D; s' M* j0 Z4 i: g
临床可能性
! d: P* b$ E5 j$ q5 z
“这项研究也为思考靶向患者细胞中毒性DPRs及其作用位点的可能疗法提供了新的方向,” 该研究第一作者、Kriwacki实验室博士后研究员Michael White博士说道。
( r. }/ R& j# u( V' O: i) b8 ?
“成功需要完全创新的方法,” Kriwacki说,“但至少现在我们知道了需要针对的目标。”
% j2 Y' U1 y" F
A3 {! U+ e( v" L





 发表于 2019-4-15 22:31:28
发表于 2019-4-15 22:31:28


 发表于 2019-4-15 22:33:56
发表于 2019-4-15 22:33:56


 发表于 2019-4-16 07:42:33
发表于 2019-4-16 07:42:33

