- q; |) t/ w9 `& Z- a4 l8 k
" Z6 D' X5 z, E6 _
2 [- [* w. m. O V* X; i; h7 [0 q! C
一项最近发表于《科学报告》(Scientific Reports)的研究发现,移植某些人类骨髓细胞能够通过修复保护脊髓的屏障而改善ALS小鼠的运动功能,并保留运动神经元。
: O! Z2 e7 I) F4 y4 |/ ]* m1 F% ~
3 _! c. K4 }3 F$ M* W
血脑屏障(BBB)和血脊髓屏障(BSCB)由位于毛细血管壁上的内皮细胞、周皮细胞以及星形胶质细胞的脚板组成。
0 n" B, e, |5 _$ ]
越来越多的证据表明,在患者和动物模型中,这些组分的损伤都与ALS有关。如果这些屏障被破坏,免疫细胞和其他潜在有害物质可能从血液循环进入中枢神经系统,加剧ALS的特征——运动神经元变性退化。
* l0 E, r; c+ E9 _# ^
南佛罗里达大学的研究团队之前在ALS小鼠中表明:包含CD34标志物(hBM34+)的人类骨髓细胞可能成为ALS治疗策略,因为它们能够延迟疾病进展,保护运动神经元生存,减少损伤反应标志物并维护屏障的完整性。移植的细胞分化成内皮细胞,并嵌套在脊髓的毛细血管中。
7 j. _% Q2 h1 N. f, O- U
在同一小鼠模型(G93A)中进行的后续研究显示,大剂量的移植细胞可以恢复毛细血管的精细结构,稳定它们在脊髓中的密度,同时还能改善髓鞘(保护神经的绝缘层)的完整性。
5 Q1 ? b2 R( r$ ]+ Z
尽管这些发现支持使用这些细胞来修复BSCB并改善ALS相关问题,但hBM34+细胞对运动功能最显著的影响是在移植后4周确定的,而且即使是高剂量治疗后依然能检测到脊髓毛细血管的明显损伤。
# B9 P; K" I# V2 `! Y2 P
研究团队因此测试了人类内皮祖细胞(EPCs)——源于骨髓,但比未分化的干细胞更接近内皮细胞——能否在G93A小鼠中提供更好的BSCB修复。
# d7 i$ [ L: g, ]7 l M+ C$ |$ j
# k3 K" z/ Z9 g/ r
通过静脉输注移植后2到3周,在伸展反射评分、握力和运动协调性的评估方面,接受EPCs的小鼠比对照组体重明显更大、运动功能更好,疾病进展更为缓慢。
6 [8 w2 i! N5 H- W7 P# r9 @ o
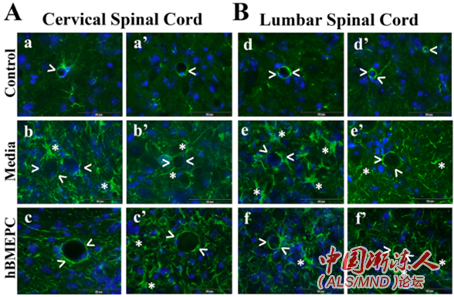
在第4周,这些小鼠还表现出与EPCs广泛附着于颈、腰椎脊髓、大脑运动皮质和脑干中毛细血管相关的BSCB修复,这几个区域以运动神经元退化而闻名。
% ?" o, s5 r1 k% ]; `+ q& C
颈椎和腰椎脊髓的其他改善包括毛细血管和周皮细胞结构的恢复、星形细胞突起的正常化、脊髓内渗漏减少以及脊髓运动神经元生存时间延长。接受移植的小鼠只有一小部分运动神经元出现退化迹象,运动神经元的数量多于对照组。
) P: U, p9 j/ j1 O- c; K+ ]
在提醒还需要进一步研究的同时,研究团队评论说,“从转化的角度看,在症状发生后的疾病阶段启动细胞治疗,强有力地恢复了BSCB完整性,并显示出作为ALS未来临床疗法的前景。”
( x& {# h9 ?/ C
+ _9 l% O) r! G6 z1 `" n: Y 




 发表于 2019-4-29 00:53:27
发表于 2019-4-29 00:53:27

 发表于 2019-4-29 01:05:11
发表于 2019-4-29 01:05:11


