肌萎缩侧索硬化症(ALS)是一种严重的致命神经退行性疾病。虽然小鼠研究识别出了若干潜在治疗方法,但这些药物在人体试验中往往表现不佳。
8 h1 m' I K; o7 q7 ?7 |1 q
波士顿儿童医院F.M. Kirby神经生物学中心主任Clifford Woolf博士说:“药物发现中最困难的挑战之一是如何识别出在疾病过程中起关键作用的靶点。”
0 C8 x$ d9 F& r* U
在最近发表于《细胞·报告》(Cell Reports)的研究中,与辉瑞公司合作,Woolf博士和同事们开发出一种发现这些靶点的高通量平台。使用衍生自ALS患者的运动神经元,并结合成像技术来测量神经元暴露于不同药物前后的超兴奋性即过度 “放电” 的倾向。
: }' m1 m8 D5 g6 }) T1 t4 L, I
6 ^2 V" P/ l8 g4 \$ h
超兴奋性是ALS的主要特征。利用该平台,Woolf博士和研究第一作者Xuan Huang及Kasper Roet博士确认了两个已知的ALS药物靶点。他们还识别出一个新的靶点,该靶点是ALS研究中前所未见的,而且可以用现有的药物进行干预。
8 v- l% v/ K2 \+ n& a. n7 G
检测失控动作电位
, J/ A* O Y( t! u
Woolf博士和同事们之前发现,携带ALS突变的运动神经元比正常运动神经元更为兴奋。这种超兴奋性——以及使其平静下来的前景——是新探索平台的核心。
$ T8 ?+ ]0 t; z3 U/ }& I) E! I5 {
Woolf博士说:“超兴奋性会使运动神经元更容易退化并最终死亡。通过旨在逆转运动神经元超兴奋性的筛选,我们能够发现ALS的新靶点和疾病机制,并以无偏见的方式确认其他(靶点)。”
& E+ |( m3 z+ K( f9 w% u
" i6 r, ^0 T: [. {
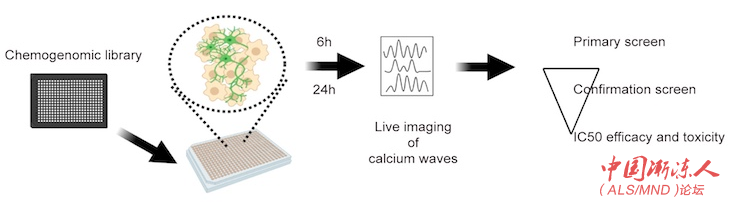
运动神经元超兴奋性筛选示意图:该高通量筛选系统旨在识别能够降低运动神经元兴奋性的化合物。研究人员将患者源性运动神经元在384孔板中培养。3到4周后,加入小分子化学库中已知分子靶点的化合物。6小时和24小时后进行实时GCaMP钙成像测量兴奋性。针对通过第一轮筛选识别的化合物再进行确认筛选,并直接测试其功效和毒性。
3 |* b1 Y/ G4 C2 e- y9 H* n
为了制造运动神经元,研究人员获得了由哈佛大学Kevin Eggan博士实验室使用携带SOD1(A4V)突变的ALS患者组织样本培育的诱导多能干细胞。然后,他们将干细胞分化为运动神经元,装入384-孔板(384-well plate),并将其暴露于各种药物。
& ?+ b- Q6 z5 v% B9 _# Y; A
为了测量兴奋性,研究人员使用了GCaMP成像技术,扫描钙水平的荧光标志物。这是神经元触发动作电位频率的一个指标,也是对超兴奋性的一种测量。
0 C1 l" u2 r' l$ c6 N2 e3 U7 I
使过度兴奋的神经元平静下来
7 K L( k4 ]0 H# a. h
研究人员筛选了辉瑞公司药物库中的2900种已知药物。经过3轮筛选,他们发现了67种化合物。这些化合物可以降低患者源性运动神经元的超兴奋性,而不会引起毒性。
) q9 @4 b. ]2 q
V0 n- k ?2 b+ [" ^ x1 [
( I. V+ \/ F" \8 s& q: n3 f
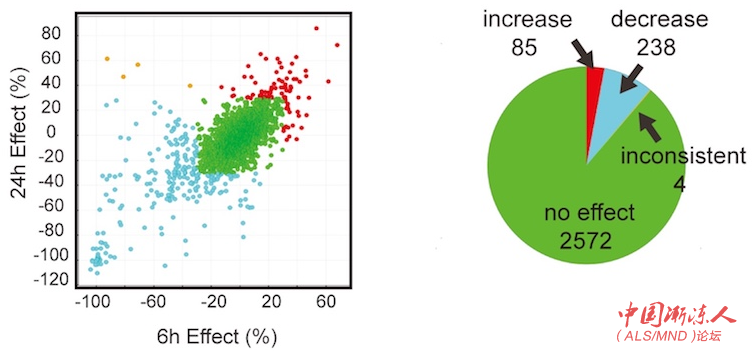
第一轮筛选结果:左图中,光点表示不同化合物6小时和24小时对运动神经元兴奋性的平均影响。红点是增加兴奋性的化合物,蓝点是降低兴奋性的化合物,绿点是没有效果的化合物。左上角一些橙色的点表示6小时和24小时的结果不一致。右侧饼状图对结果进行了量化。
( Z6 j: l$ c0 S2 |$ p8 S5 Y% [
该研究还发现了一类很有前途的新候选药物——多巴胺D2受体 (DRD2) 激动剂。DRD2在运动神经元超兴奋性中的作用之前没有被认识到。此外,一些DRD2激动剂(bromocriptine、sumanirole)已经上市,开辟了针对ALS患者进行测试的可能性。
5 A7 `5 Q* J1 O3 ]! u) u. U6 F) a
Woolf博士说:“我们的结果表明,神经元兴奋性筛选是发现相关药物靶点的强大平台。我们相信它可以应用于涉及神经元兴奋性的其他神经疾病,比如癫痫和其他神经退行性疾病,比如阿尔茨海默病。”
- i4 c% f4 P7 k- b
7 m9 j7 h" ?2 z& m9 I
( i( S* {) p* q. ?, z& Z* S' B





 发表于 2021-8-5 13:13:38
发表于 2021-8-5 13:13:38

 发表于 2021-8-5 14:33:41
发表于 2021-8-5 14:33:41